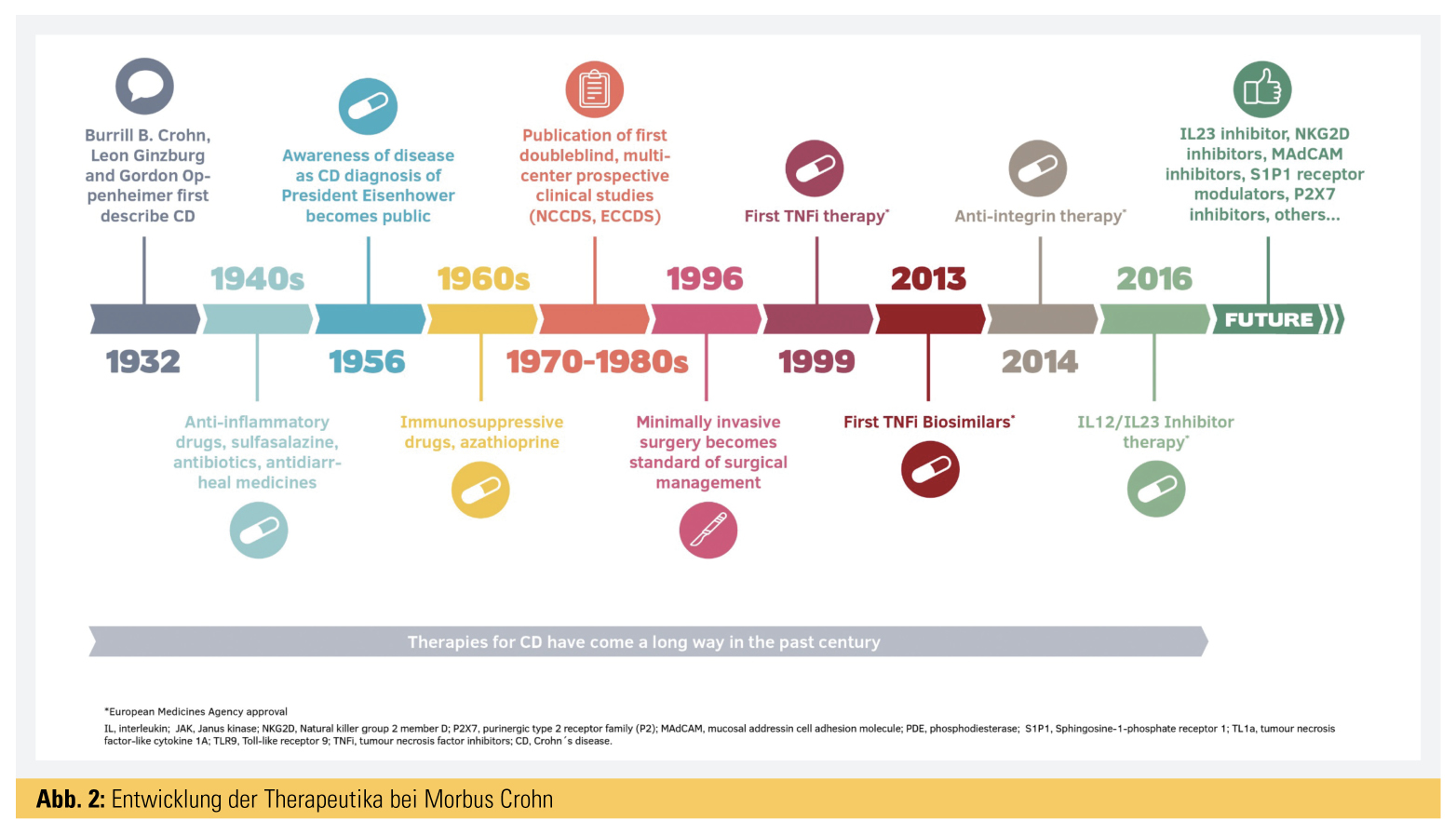
Therapie der CED – Entwicklung der letzten 20 Jahre
Immunsuppressiva
Während in den 1980er-Jahren die große Ära der neuaufgekommenen Mesalazin-(5-Aminosalicylsäure-)Präparate war und später auch lokal wirksame Steroide mit Budesonid als Wirkstoff auf den Markt kamen, die allerdings eher nur leichte bis moderate Schübe behandeln konnten, wurden in den 90er-Jahren des letzten Jahrtausends immer mehr die Therapien mit Immunsuppressiva wie Azathioprin und 6-Mercaptopurin forciert. Diese Therapie wurde primär standardmäßig von den Pädiatern bei Beginn des Morbus Crohn im Kindesalter eingesetzt, wobei eine ausgezeichnete Wirksamkeit und meist tiefe Remission über viele Jahre erreicht werden konnte. Überdies konnte damit Kortison abgesetzt werden, und diese Patienten – in tiefer Remission – hatten kaum Komplikationen, wenn die Immunsuppression bald nach dem Beginn der Erkrankung angesetzt wurde. Bis heute haben diese Präparate im Kindesalter ihren fixen Platz; im Erwachsenenalter ist besonders ab dem Alter von 50 oder 60 Jahren die Problematik eines eventuellen Tumorrisikos aufgekommen. Einerseits wird durch die Ablagerung von Stoffwechselprodukten in der Haut die Sonnenempfindlichkeit und das Risiko für Hauttumoren erhöht, über 60 Jahre erhöht sich auch etwas das Lymphkrebsrisiko, weshalb diese Therapie bei älteren Patienten kaum mehr eingesetzt wird.
Biologika
Es folgte die Entwicklung spezifischer Antikörper – sogenannter Biologika-Therapien –, die im Labor gegen verschiedene entzündungsaktive Stoffe (z. B. primär gegen Tumornekrosefaktor-α) konstruiert wurden, wobei schon 1995 in ersten Studien klinische Erfolge von Infliximab nachgewiesen wurden.
Infliximab: 1999 wurde schließlich Infliximab als erster Anti-TNF-Antikörper zugelassen und zeigte trotz seiner Immunsuppressivität doch einen deutlichen Vorteil gegenüber den bisherigen Therapien, sowohl in der stärkeren Wirksamkeit im Vergleich zur Azathioprin als auch in den verminderten Nebenwirkungen. Vor jeder Biologika-Therapie ist ein sogenanntes Anti-TNF-Screening auf mögliche Kontraindikationen, wie akute GI-Infektionen (z. B. Clostridium-difficile-Toxin …), latente Tuberkulose, Hepatitis B, verpflichtend (vgl. Checkliste Anti-TNF-Antikörper Update 2019). Der Impfstatus sollte aufgefrischt werden (z. B. FSME, Influenza, Pneumokokken, evtl. H. Zoster). Infliximab wurde schließlich neben Morbus Crohn auch für Colitis ulcerosa und auch für die Fisteltherapie, für die Therapie bei Kindern und bei anderen IMIDs („immune-mediated inflammatory diseases“) wie RA, SpA und Psoriasis zugelassen. Während anfangs die Therapie ohne Kontrolle von Wirkspiegeln durchgeführt wurde, zeigte sich in den letzten Jahren deutlich, dass die sogenannten Durchgangsspiegel (Through-Spiegel) vor der nächsten Infusion/Injektion ausschlaggebend für die Wirksamkeit und das Erreichen von tiefen Remissionen sind. Überdies besteht hier das Risiko einer Anti-Drug-Antikörperbildung (ADAs), die schließlich zur Neutralisierung und Unwirksamkeit dieser Medikamente führen. Diese ADAs kann man im Blut nachweisen. Eine gleichzeitige Therapie mit Azathioprin kann die ADA-Bildung verhindern bzw. reduzieren und die Wirkspiegel von Infliximab erhöhen. Insofern hat sich dann auch diese Kombinationstherapie bei schweren Verläufen als noch wirksamer als die Einzeltherapie mit Infliximab erwiesen.
Adalimumab: 2006 wurde schließlich auch Adalimumab als erster subkutaner monoklonaler Antikörper gegen TNF-alpha zugelassen, in der Folge für Crohn, Colitis und auch für EIM (extraintestinale Manifestationen) und/oder IMIDs. Diese Therapie erlaubt eine höhere Flexibilität für die Patienten, da die Injektion vom Patienten selbst unter die Haut (subkutan) gespritzt werden kann, während bei Infliximab die Infusionen in Infusionszentren oder bei niedergelassenen Ärzten gegeben werden müssen. Andererseits erfordert es doch eine größere Einschulung – sowohl für die Verabreichung dieser Spritzen als auch für die daraus resultierende Eigenverantwortung des Patienten, wann er sich die Spritzen geben darf und wann er pausieren bzw. den behandelnden Arzt fragen sollte.
CED-Nurses: In dieser Zeit erfolgte dann auch die Eingliederung von sogenannten CED-Schwestern in das CED-Betreuungsteam, wobei diese Schwestern insbesondere für die Schulung der Patienten, aber auch als Ansprechpartner in verschiedenen Beratungssituationen der CED-Patienten hilfreich sein könnten. Leider ist dieses Berufsbild in Österreich noch immer nicht fix verankert, obwohl nun schon in 2-jährigem Rhythmus eine diesbezügliche Ausbildung der CED-Schwestern in Graz durchgeführt wird.
Golimumab: In der Folge gab es dann auch eine Zulassung für den dritten Anti-TNF-Antikörper Golimumab (Simponi®) bei Colitis ulcerosa, der ebenfalls subkutan gegeben wird.
Biosimilars: In den letzten Jahren liefen die Patente der erstzugelassenen Infliximab und Adalimumab ab, und es gab eine Zulassung für Biosimilare für diese Präparate, sodass die Therapie bedeutend billiger wurde und wahrscheinlich in Hinkunft in größerem Maßstab verabreicht werden kann.
Vedolizumab: 2014 wurde Vedolizumab unter dem Namen Entyvio® in der EU zugelassen, sowohl für Colitis ulcerosa als auch für Morbus Crohn, wobei hier erstmals ein monoklonaler Antikörper gegen Integrine mit selektiver Wirkung auf den Darm gefunden wurde. Dieser verhindert das Einwandern von Entzündungszellen in den entzündeten Darm und ist besonders bei Dickdarmentzündungen gut wirksam. Durch die relativ selektive Wirkung im Darm besteht ein vermindertes Risiko für systemische Infektionen, und er ist wahrscheinlich auch für den älteren Patienten wegen des geringen Infektionsrisikos und wahrscheinlich auch Tumorrisikos besser geeignet. Überdies gibt es keine Risiken für MS-Patienten bzw. Herzinsuffizienzpatienten.
Ustekinumab: 2016 erfolgte schließlich die Zulassung des IL-12- und IL-23-Antikörpers Ustekinumab unter dem Namen Stelara® für Morbus Crohn, was insbesondere auch bei gewissen Hautnebenwirkungen unter Anti-TNF-Therapie bei Patienten mit Morbus Crohn und psoriasisartigen Veränderungen beträchtliche Vorteile erbrachte. Überdies gibt es Patienten, die auf diese Therapie im Gegensatz zu Anti-TNF-Therapien besser ansprechen. Diese Therapie wird primär als Infusion und in der Folge in 8–12-wöchigen Abständen subkutan selbst vom Patienten verabreicht. Primär wurde diese Therapie für die Psoriasis zugelassen. Für Herbst 2019 ist auch eine Zulassung für Colitis ulcerosa zu erwarten.
„Small molecules“
Während all diese Antikörpertherapien relativ große Moleküle verwenden und deswegen nur als Infusion bzw. Spritzen gegeben werden konnten, versuchte man nun, kleinere Moleküle zu geben, die man auch schlucken könnte.
Tofacitinib: Als erstes der kleineren Moleküle erlangte Tofacitinib unter den Namen Xeljanz® 2017 seine Zulassung in der EU. Es ist ein sogenannter JAK-Antagonist, der direkt an der Entzündungszelle ansetzt und dort zentral die Produktion von verschiedensten Entzündungsfaktoren (Zytokine) verhindert. Tofacitinib ist sowohl für Colitis als auch für RA zugelassen, sodass hier das besondere Indikationsgebiet für dieses neue orale Medikament liegen dürfte. Nicht zu empfehlen ist das Präparat für Patienten mit Herpes Zoster bzw. Thromboserisiko. Weiters werden derzeit in Studien verschiedenste Nachfolger der eben genannten Medikamente und neuere Wirkstoffklassen getestet, sodass in den nächsten Jahren – bis 2023 – mit weiteren interessanten Zulassungen als Therapiealternative für die bisherigen Medikamente zu rechnen ist.
Strategische Innovation
Eine wesentliche strategische Innovation brachte die Einführung des Calprotectin-Tests im Stuhl, der nun neben den Symptomen des Patienten der Hauptzielparameter in der
Therapie von Crohn und Colitis ist. Er ist wesentlich sensibler als CRP im Serum und korreliert gut mit der endoskopischen und histologischen Aktivität dieser Erkrankungen. Das primäre Ziel ist es, das Calprotectin unter 250 bis 300 mg/kg (abhängig vom Kit) zu drücken, weil dann das Rezidivrisiko im nächsten Jahr sehr gering ist (< 10 %). Werte unter 100 mg/kg lassen eine tiefe Remission vermuten.