Therapie myelodysplastischer Syndrome (MDS)
Myelodysplastische Syndrome (MDS) sind klonale Stammzellerkrankungen des höheren Lebensalters (Altersmedian > 60 Jahre) mit peripherer Zytopenie (meist therapierefraktäre Anämie) und hyperzellulärer, dysplastischer Knochenmarkveränderung. In den letzten Jahren konnten neben der Diagnostik und Prognoseabschätzung mit neuen Therapieoptionen bedeutende Fortschritte erzielt werden:
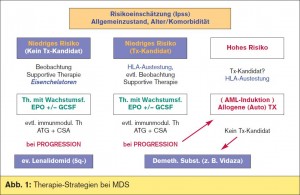
Prognose- und Risikoabschätzung
Gemäß der WHO-Klassifikation (2008) und Prognosescores (IPSS,1997, und WPSS, 2005), die vorwiegend den Grad der Zytopenie, medullären Blastenanteil, den Transfusionsbedarf und die Chromosomenveränderungen der Hämatopoese berücksichtigen, kann die Prognose des einzelnen Patienten abgeschätzt werden. Wir können somit Patienten identifizieren (Low Risk/Intermediate I), bei denen ein langer Krankheitsverlauf wahrscheinlich ist, und Patienten (Intermediate II/High Risk) mit kurzer Überlebenswahrscheinlichkeit (unter 12 Monaten).
Zusätzlich müssen jedoch vor einer Therapieentscheidung der Allgemeinzustand und die Komorbiditäten des Patienten beachtet werden.
Therapie von Niedrigrisiko-Patienten
Bei der Mehrzahl der alten MDS-Patienten (medianes Alter: 75 Jahre) sind palliative Therapiestrategien indiziert. Supportive Therapien mit Erythrozytenkonzentraten oder Wachstumsfaktoren (Erythropoetin 150–300 U/kg 3 x/Woche s. c., ev. mit G-CSF) können bei Niedrigrisiko-Patienten eingesetzt werden. Prädiktive Faktoren für das Therapieansprechen sind:
1. endogener Erythropoetinspiegel < 200 (500) IE/ml oder
2. geringe Transfusionsabhängigkeit (maximal 2 EK [Erytrozytenkonzentrate] in 8 Wochen).
Da jedoch die Eisenüberladung (bei hohem Transfusionsbedarf) einen prognostisch ungünstigen Faktor darstellt, sollte bei diesen Patienten an eine Eisenchelator-Therapie gedacht werden. Bei Patienten, die Desferal ® nicht oder ungenügend tolerieren, steht ein oral wirksamer Eisenchelator, Deferasirox (Exjade ®), zur Verfügung mit hoher Selektivität für dreiwertiges Eisen. Ein weiteres therapeutisches Konzept ist die immunmodulierende- bzw. immunsuppressive Therapie (z. B. mit Cyclosporin oder Antithymozytenglobulin wie bei der aplastischen Anämie). Auch die immunmodulierenden Substanzen Thalidomid bzw. der CD52-Antikörper Campath erbrachten bei MDS-Patienten ohne Blastenvermehrung gute Stabilisierungen. Das orale Thalidomid – analogon Lenalidomid (Revlimid®) zeigte besonders bei MDS-Patienten mit einer singulären oder komplexen Chromosomenaberration des Chromosoms 5 (5q-Deletionen) eine hohe Ansprechrate. Mit einem Ansprechen von über 60 % und einer Normalisierung der pathologischen Chromosomenbefunde bei ca. 40 % stellt diese Substanz eine wirksame und nebenwirkungsarme Alternative dar. Die Lebensqualität der MDS-Patienten wurde damit signifikant verbessert. Ob Lenalidomid auch bei anderen MDS-Subgruppen (ev. in Kombination) verbesserte Remissionsraten ermöglicht, wird derzeit in Studien überprüft. Eine mögliche Option stellt auch die Therapie mit Valproinsäure dar, einem Histon-Deacetylase- Inhibitor (HDAC-Inhibitor), der in steigender Dosierung (beginnend mit 500 mg/d) verabreicht wird (diese Substanz ist jedoch für MDS-Patienten nicht registriert). Die Effektivität anderer HDAC-Hemmer wird derzeit ebenfalls in klinischen Studien überprüft.
Therapie von Hochrisiko-Patienten
Eine intensive AML-Induktionstherapie ist bei diesen überwiegend alten Patienten meist sehr toxisch und selbst komplette Remissionen sind nur von kurzer Dauer. Diese Therapie kann vor einer Transplantation sinnvoll sein, muss jedoch im Einzelfall genau überlegt werden.
Epigenetische Therapie: Ein neues therapeutisches Prinzip ist die epigenetische Therapie der DNA-Demethylierung: Tumor-(Leukämie-) – Zellen zeigen bezüglich ihres DNA-Methylierungsmusters ein spezifisches Verhalten, z. B. wird die DNA-Methyltransferase hochreguliert. Zwei neue Substanzen, 5-Azacytidin (Vidaza®, seit 2008 in Europa zugelassen) und 5-Aza- 2-Deoxycytidin (Decitabin), sind aufgrund dieses Wirkungsprinzips bei MDS-Patienten eingesetzt worden. Beide zeigen – bei geringer Nebenwirkungsrate – ein gutes Ansprechen, das jedoch manchmal erst nach Monaten Therapiedauer sichtbar wird. Besonders Hochrisiko- MDS-Patienten mit komplexem Karyotyp konnten in Remission gebracht werden und in Studien signifikante Überlebensvorteile erreichen. Diese Therapiekonzepte mit reduzierter Nebenwirkungsrate sind besonders auch als Vorbereitung einer Stammzelltransplantation interessant.
5-Azacytidin ist für
1. MDS mit IPSS Int-2/High Risk
2. AML (bis 30 % Blasten) und multi – lineärer Dysplasie
3. und CMML < 13 G/l Leukozyten (dysplastische Variante) zugelassen.
Kombinationen von DNA-methylierenden Substanzen mit anderen neuen Medikamenten (z. B. Histondeacetylase-Inhibitoren) werden ebenfalls in Studien geprüft.
Lenalidomid bei CMML: Da es für die chronisch- myelomonozytäre Leukämie (eine myelodysplastische/ myeloproliferative Erkrankung) keine Standardtherapie gibt, wurde in Österreich eine klinische Studie mit Lenalidomid initiiert, die interessante Ergebnisse bringen wird.
Kurative Therapie bei MDS
Das einzige kurative Therapiekonzept für MDSPatienten stellt heute die allogene Stammzelltransplantation (von einem [möglichst HLAidenten] Familien- bzw. Fremdspender) dar. Vor der Transplantation sollte, wenn es der Allgemeinzustand des Patienten erlaubt, mittels einer AML-Induktion eine Remission erzielt werden. Auch bei älteren Patienten mit „Hochrisiko“-MDS können durch neue dosisreduzierte Konditionierungs-Schemata Transplantationen erfolgreich durchgeführt werden, trotzdem ist die Stammzelltransplantation nach wie vor durch eine Mortalitätsrate von 10–30 % gekennzeichnet. Daher ist eine frühzeitige Evaluierung notwendig, welcher Patient wann transplantiert werden soll, und eine HLA-Austestung des Patienten und seiner Geschwister bei diesen Erkrankten rasch anzustreben.
ZUSAMMENFASSUNG: In den letzten Jahren haben zahlreiche neue Entwicklungen in der Diagnostik und Therapie der myelodysplastischen Syndrome stattgefunden. Daher sollte jeder Patient mit Verdacht auf MDS einem hämatologisch-onkologischem Zentrum vorgestellt werden, das eine umfassende Diagnostik mit Risikoeinschätzung durchführt und ein Therapiekonzept erstellt. Eine MDSPlattform (von österreichischen MDS-Spezialisten) im Rahmen der Österreichischen Gesellschaft für Hämatologie und Onkologie (www.oegho.at) wurde gegründet, um Ärzte und Patienten über neue Therapieoptionen zu informieren.
FACT-BOX
• Neue Klassifikationen (WHO 2008) und Prognosescores (IPSS/WPSS) charakterisieren das Risiko einzelner MDSSubtypen besser. • Die Komorbidität stellt einen wichtigen Faktor für die Therapieentscheidung dar. • Bei Niedrigrisiko-MDS sollte der Eisenüberladung Beachtung geschenkt werden. Erythropoetine sind indiziert, Lenalidomid ist die Therapieoption für das 5q-Syndrom. • Bei Hochrisiko-MDS ist Vidaza® eine gute Therapieoption; auch bei älteren Patienten sollte an die Möglichkeit der (kurativen) dosisreduzierten Stammzelltransplantation gedacht werden.