Lupus erythematodes – Umwelt und Autoimmunerkrankungen
UV-Strahlung
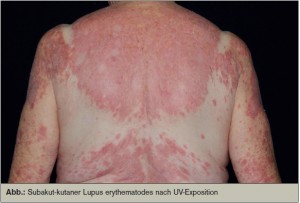
UV-Strahlung löst in Keratinozyten Apoptose aus und führt zur Expression von Oberflächenmarkern, die sonst nur im Zytoplasma und Zellkern vorhanden sind. So werden diese versteckten Antigene plötzlich für das Immunsystem sichtbar und lösen eine Immunantwort aus. Eine Entzündung und das Auftreten zirkulierender Autoantikörper (z. B. Ro/SSA oder La/SSB, die häufig mit Kollagenosen assoziiert sind) sind die Folge. UV-Strahlung kann somit einen LE und auch Schübe bei vorbestehendem LE auslösen (> Abb.). Daher ist konsequenter Sonnenschutz eine wichtige Basistherapie, wobei sich dieser nicht nur auf die regelmäßige Applikation von Sonnencremes (mindestens Faktor 30) beschränken darf, sondern auch textilen Sonnenschutz und richtiges Verhalten (Aufenthalt im Schatten bzw. Innenraum in der Mittagszeit) inkludiert.
Infektionen
Infektionen sind bekannte Auslöser von Lupus erythematodes und LE-Schüben, die auf dem Boden einer genetischen Neigung zu Fehlregulationen des Immunsystems mit Bildung von Autoantikörpern, Toleranzaufhebung gegenüber Autoantigenen und Beeinflussung von Apoptose führen.
So sind z. B. Antikörper gegen das Epstein- Barr-Virus (EBV) kreuzreaktiv mit Lupus-spezifischen Sm-Antikörpern. EBV-DNA fand sich in einer Studie bei 100 % von 32 jungen LEPatienten, gegenüber nur 65 % im Kollektiv der Kontrollpersonen. Ob EBV-Infektionen den LE auslösen oder LE-Patienten gegenüber EBV empfindlicher sind, ist noch unklar.
Ein weiteres Beispiel: Bestimmte Proteine des Vesicular stomatitis virus (VSV) sind kreuzreaktiv mit Ro/SSA. Eine Immunantwort gegen VSV kann daher eine entsprechende Autoantikörper-Produktion auslösen.
Medikamente
Zahlreiche Medikamente können einen LE auslösen, der medikamentös induzierte systemische Lupus erythematodes (SLE) ist eine eigene Entität. Entsprechende Medikamente bewirken eine Hypomethylierung der DNA von T-Lymphozyten, welche einen Anstieg des Lymphozyten-Funktions-assoziierten-Antigens (LFA-1) zur Folge hat und eine Autoantikörper- Produktion in Gang setzen kann. Klinisch stehen, im Gegensatz zum klassischen SLE, eine Polyarthritis und Serositis im Vordergrund, laborchemisch finden sich oft keine Antikörper gegen doppelsträngige DNA (ds-DNA-AK), meist aber Histon-AK. Das Absetzen des auslösenden Medikaments (z. B. Hydralazin, Procainamid, Minozyklin, Betablocker, Chlorpromazin, Quinidin, Sulfonamide, Tetrazykline, TNF-alpha-Blocker u. a.) ist die wichtigste therapeutische Maßnahme.
Der medikamentös induzierte subakut kutane Lupus erythematodes (SCLE) zeigt, im Gegensatz zum klassischen SCLE, meist einen sehr ausgedehnten Hautbefall, oft auch ein Schmetterlingserythem, bullöse und Erythema- multiforme-artige Veränderungen sowie Vaskulitiszeichen (tastbare Purpura). Auch hier muss das auslösende Medikament (z. B. Hydrochlorothiazid, Kalziumantagonisten, Cimetidin, Griseofulvin, Leflunomid, Terbinafin u. a.) identifiziert und abgesetzt werden.
Eine Östrogen-Medikation hingegen kann einen klassischen LE auslösen und verstärken. Auf molekularer Ebene scheint eine Erhöhung der Calcineurin-Phosphatase-Aktivität in T-Lymphozyten bedeutsam zu sein. Daher ist auch die deutliche Präferenz des weiblichen Geschlechts zu erklären. Eine exogene Östrogenzufuhr ist somit bei LE-Patientinnen zu meiden und andere Kontrazeptiva zu bevorzugen. Auch Isoflavonoide können das Risiko eines LE erhöhen.
Chemische Noxen
Aromatische Amine, Hydrazin, Haarfarben und Tabakrauch wurden mit der Entwicklung eines SLE in Zusammenhang gebracht. Nikotinkonsum ist ein viel diskutierter, hochwahrscheinlicher Aggravationsfaktor bei LE. Die Studienlage ist diesbezüglich jedoch teils kontroversiell, sodass hier noch keine endgültige Beurteilung möglich ist. In Anbetracht der multiplen gesundheitsschädigenden Folgen des Rauchens ist grundsätzlich auch bei LE-Patienten strikt davon abzuraten.
Die Exposition gegenüber Silika und organischen Lösungsmitteln kann zu SLE und Sklerodermie führen und kann die Bildung von Autoantikörpern provozieren. Auch das Arbeiten in Uranminen ist ein signifikanter Risikofaktor für die Entstehung einer Sklerodermie. Silika führt zur Bildung von Anti-Topoisomerase-(Scl-70)-Antikörpern, die bei schwerer diffuser Sklerodermie nachweisbar sind. Ebenso binden organische Lösungsmittel an Topoisomerase. Weitere Autoantikörper gegen Nukleolen, dsDNA, Ro/SSA, La/SSB und U1RNP konnten bei diesen Personen in einem höheren Prozentsatz nachgewiesen werden. Ein signifikanter Zusammenhang zur Entstehung einer Sklerodermie konnte nach Kontakt mit Trichloräthylen, chlorierten und aromatischen Lösungsmitteln, Toluen, Ketonen, Farbverdünnern, Mineralöl und Schweißdämpfen nachgewiesen werden. Obwohl immer wieder diskutiert, fand sich in Metaanalysen keine Signifikanz bei der Entstehung von Kollagenosen nach Kontakt mit Silikon-Brustimplantaten.
Pseudosklerodermien
Nicht zu übersehen sind Pseudosklerodermien, die nicht zu den klassischen Autoimmunerkrankungen gezählt werden aber auch durch Medikamente bzw. externe Faktoren ausgelöst werden. Beispiele sind die nephrogene Fibrose bei Niereninsuffizienten nach Untersuchungen mit Gadolinium-hältigen Kontrastmitteln, das Eosinophilie-Myalgie-Syndrom nach Einnahme von L-Tryptophan als Nahrungsergänzungsmittel, das Toxic-Oil-Syndrom nach Konsum eines mit Anilin denaturierten Rapssamenöls oder die Sklerodermie nach Bleomycin-Gabe. All diesen sklerodermatischen Zuständen liegt eine Stimulierung des Tissue Growth Factor beta (TGF-_) zugrunde, der zu einer Kollagenneubildung führt. Diese bekannten Noxen können für verschiedene klinische Erscheinungsbilder von Autoimmunerkrankungen verantwortlich sein. Präventive Maßnahmen zur Verhinderung dieser extern induzierten Erkrankungen sollten ergriffen werden.
FACT-BOX
Umweltfaktoren können eigene Krankheitsbilder oder Krankheitsschübe bei entsprechender genetischer Disposition auslösen, wie den Lupus erythematodes nach viralen Infektionen oder Medikamenten, das Antiphospholipid- Syndrom mit Thrombosen und Vaskulopathien an Haut und inneren Organen nach viralen und bakteriellen Infektionen, oder auch Vaskulitiden im Rahmen einer Hepatitis-C-Infektion. Die systemische Sklerodermie kann z. B. nach einer Borrelieninfektion exazerbieren, aber auch durch Exposition mit Silika-Staub, organischen Lösungsmitteln wie Vinylchlorid oder Epoxy-Harzen oder auch durch Medikamente wie Bleomycin verursacht werden.
Literatur:
– D’Cruz D.: Autoimmune diseases associated with drugs, chemicals and environmental factors. Toxicology Letters 2000; 112-113: 421-32
– Dighiero G., Rose N.R.: Critical self epitopes are key to the understanding of selftolerance and autoimmunitiy. Immunol Today 1999; 20:423-428
– Herndorn T.M., Tsokos G.C.: What is autoimmunity: Basic mechanism and concepts. In: Kuhn A., Lehmann P., Ruzicka T. (eds.): Cutaneous lupus erythematodes. Springer, 2005, pp 3-17
– Kivity S., Agmon-Levin N., Blank M., Shoenfeld Y.: Infections and autoimmunity – friends or foes? Trends Immunol 2009; 30 (8):409-14
– Lipworth L., Holmich L.R., McLaughlin J.K.: Silicone breast implants and connective tissue disease: no association. Semin Immunopathol 2011 May; 33 (3):287-94. Review