Unnötig lange Antibiotikaverordnungen: Die verflixten „10 Tage“
Zu niedrige Tagesdosen und zu lange Therapiedauer sind die wichtigsten Risikofaktoren für das „Resistent-Werden“ von Erregern unter Antibiotikagabe.
Warum behandelt man eine Infektion über 10 Tage?
In den Jahren 1949 bis 1950 leitete Capt. Lewis W. Wannamaker, Mikrobiologe und Facharzt für Pädiatrie an der Francis E. Warren Air Force Base, Wyoming, USA, eine groß angelegte Studie über die Prävention des akuten rheumatischen Fiebers nach einer Infektion durch A-Streptokokken.1 In die Studie wurden 2.340 Rekruten mit Fieber und dem Bild der exsudativen Pharyngotonsillitis eingeschlossen. Randomisiert wurde nach der Personalnummer: Soldaten mit gerader Endnummer wurden den 3 Penicillingruppen zugewiesen, solche mit ungerader Endnummer dienten als Kontrolle.
Patienten, die mit Penicillin therapiert wurden – sie erhielten das Antibiotikum in Palmöl oder Sesamöl gelöst intramuskulär – blieben bis zum Therapieende im Spital; alle Teilnehmer der Studie wurden zu einer Nachkontrolle nach 3–5 Wochen geladen. Studienteilnehmer, bei denen Fieber und Gelenkbeschwerden auftraten, waren angehalten, sich sofort im Spital zu melden. In beiden Fällen hatten die untersuchenden Ärzte keine Angaben über die Personalnummer, wussten also nicht, welcher der Gruppen die Personen zuzuordnen waren. Definiert wurde das rheumatische Fieber nach den damals bereits publizierten Jones-Kriterien, unterstützt durch den Nachweis eines signifikanten Anstiegs des Anti-Streptolysin-A-Titer.
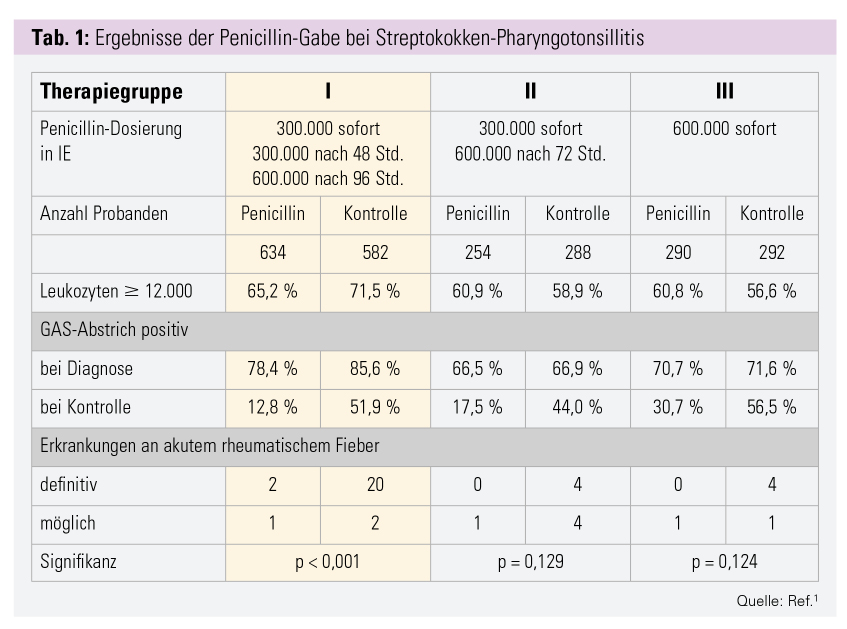
Die Basisdaten und den Outcome nach Therapiegruppe zeigt die Tabelle 1.1 In der Gruppe I mit einer Therapiedauer von 10 Tagen war die Rate an rheumatischem Fieber signifikant niedriger und die Streptokokken-Eradikation signifikant höher als in der unbehandelten Kontrollgruppe.
In allen Gruppen war die Rate an suppurativen Komplikationen so gering (Kontrollgruppe: 1-mal akute Otitis media, 1-mal Pneumonie, Penicillingruppe 1-mal peritonsilläre Zellulitis), dass keine Aussage darüber möglich war, ob eine Penicillintherapie derartigen Komplikationen vorbeugen könnte.
Zusammenfassend kann man sagen, dass das Ergebnis der Studie eine Empfehlung zur Therapiedauer lediglich in Hinblick auf Keimeradikation und Prophylaxe immunologischer Komplikationen war, Aussagen über Heilungsverlauf oder suppurative Komplikationen waren nicht Inhalt. Trotzdem scheint mit dieser Publikation die Idee, dass man Infektionen 10 Tage therapieren muss, geboren worden zu sein; eine Ansicht, die sich in der Folge offensichtlich über die ursprüngliche Indikation hinaus auch in vielen anderen Indikationen etabliert hat.
Wie lange behandelt man einen unkomplizierten HWI?
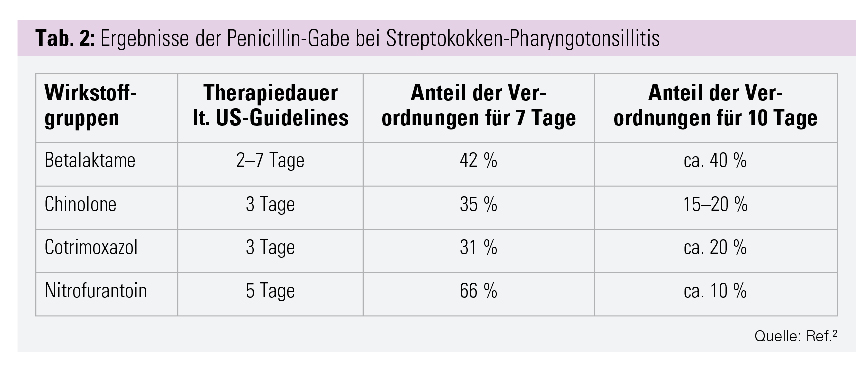
60 Jahre später machten sich US-Infektiologen die Mühe, die den Versicherungen zur Verrechnung vorgelegten Rezepte von 654.432 Frauen mit der Diagnose eines unkomplizierten Harnwegsinfektes (HWI) auszuwerten.2 Eingeschlossen wurden nur nichtschwangere Frauen im Alter von 18 bis 44 Jahren. Ausgewertet wurden Art der Antiinfektiva und Dauer der Verordnung im Vergleich zu den aktuellen Guidelines der US-Fachgesellschaften.
Das Ergebnis war eine Majorität von 7-Tage-Verordnungen in allen Substanzklassen, aber auch ein erheblicher Anteil von 10-Tage-Verordnungen. Interessant dabei ist, dass kein Rezept für länger als 10 Tage ausgestellt wurde. Eine guidelinekonforme Therapiedauer war nur bei jeder fünften Chinolon-, bei jeder vierten Cotrimoxazol- und bei jeder siebenten Nitrofurantoin-Verordnung auf den Rezepten vermerkt.
Die Frage, wie lange man einen unkomplizierten HWI therapieren soll, mag trivial klingen; nimmt man aber die Zahlen für die Gruppe der Chinolone aus Tabelle 2 – mit 284.774 Rezepten die größte Gruppe – und kalkuliert die Überschreitungen der empfohlenen Therapiedauer von 3 Tagen (35 % der Verordnungen um 4 Tage und ca. 20 % um 7 Tage zu lange), dann ergibt das etwa eine dreiviertel Million unnötiger Tagesdosen an Chinolonen.
In Österreich wurden im Jahr 2016 von den 71,6 Tonnen antimikrobiellen Wirksubstanzen, die für die Humanmedizin Verwendung fanden, 67 % im niedergelassenen Bereich und 33 % im stationären Bereich verordnet.3 Gerade die Chinolon-Resistenz bei E. coli, dem häufigsten Erreger von HWI, ist auch in Österreich recht hoch: Sie liegt bei Harnkulturen im Krankenhaus bei 17 %, im niedergelassenen Bereich bei 15 % und bei Blutkultur-Isolaten sogar bei 20 %. Die Folgen einer überlangen Therapiedauer werden sich insbesondere bei der Darmflora bemerkbar machen, aus der die Erreger der HWI meist stammen.
Was sind die Konsequenzen?
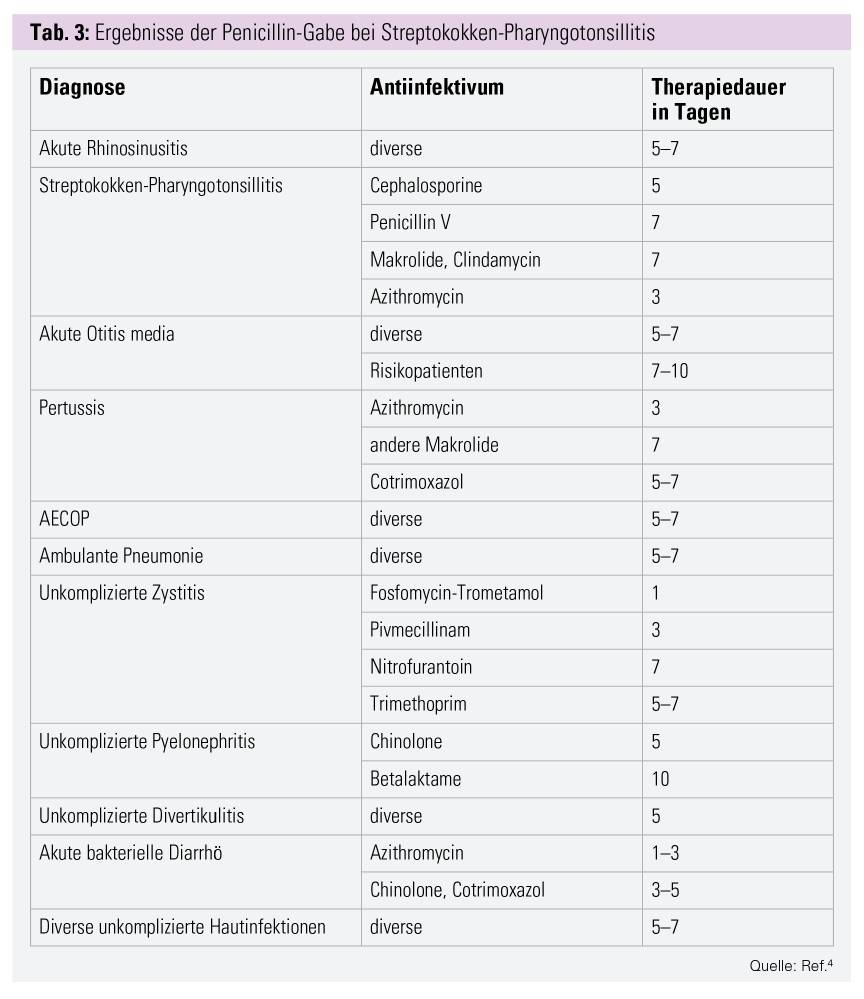
Unter dem Motto einer ausreichenden Dosierung bei ausreichend, aber nicht unnötig langer Therapiedauer hat die Neuauflage von „Arznei und Vernunft: Antiinfektiva“ dem Aspekt der Therapiedauer besondere Beachtung geschenkt (Tab. 3).4
Bei fast allen Infektionen, die typischerweise im niedergelassenen Bereich therapiert werden, sind 10 Tage Antibiotika unnötig lange. Selbstverständlich gibt es Diagnosen, bei denen man für 10 Tage oder länger Antiinfektiva verordnen wird (z. B. Clostridien-Kolitis, Helicobacter-Infektionen, Borreliose) oder manchmal für Wochen (z. B. Endokarditis) oder Monate (z. B. Osteomyelitis) verordnen muss. Besonders bei Risikopatienten, Abwehrschwäche oder schweren Verlaufsformen, respektive rezidivierenden Infekten, ist eine längere Therapiedauer notwendig.
Dessen ungeachtet sollten die ominösen 10 Tage nicht mehr Routine sein. Unnötig lange Antibiotikaverordnungen sind ein Luxus, den wir uns in Zeiten der steigenden Antibiotikaresistenzen auf keinen Fall mehr leisten sollten. Klinisch hat der Patient von 10 Tagen Antibiotika meist keinen Nutzen, dafür aber das Risiko, beim nächsten Infekt an einem resistent gewordenen Erreger zu erkranken.