Phagentherapie: Viren gegen Bakterien
Mehr als „nur“ ein Resistenzproblem
Nach einer aktuellen Studie sterben in Europa jährlich über 30.000 Menschen an Infektionen durch antibiotikaresistente Bakterien. Eine Zahl, die Schätzungen zufolge in den nächsten Jahren dramatisch steigen wird.1 Auch unabhängig von Resistenzen sind jedoch viele bakterielle Infektionen durch den bloßen Einsatz von Antibiotika nicht oder nur schwer behandelbar. Besonders in Biofilmen können Bakterien 1.000- bis 10.000-fach toleranter gegenüber Antibiotika sein als im freischwebenden Zustand. Biofilme treten zum Beispiel bei implantatassoziierten Infektionen auf, die nur dadurch behandelt werden können, dass der Biofilm samt angrenzendem Gewebe sowie oft auch der Prothese chirurgisch entfernt wird.2 Die Behandlung belastet die Patienten dabei in ähnlichem Maße wie eine Krebstherapie.3 Auch bei Schleimhaut-Biofilmen, wie bei der bakteriellen Vaginose, eradizieren Antibiotika den Biofilm nicht immer, und es kommt zu häufigen Rückfällen.4
Die Breitbandwirkung der Antibiotika hat zudem starken Einfluss auf die natürliche Zusammensetzung des Mikrobioms und führt regelmäßig dazu, dass sich ungewollte Mikroorganismen, wie beispielsweise Clostridioides difficile, unkontrolliert vermehren. Dies kann besonders bei Kindern zu lebensbedrohlichen Durchfällen führen.5 In der Scheide kommt es nach der Antibiotikatherapie oft zu Pilzinfektionen.6 Zudem wird die Zerstörung des Mikrobioms in der Schwangerschaft sogar mit neuropsychiatrischen Erkrankungen im späteren Leben des Kindes in Verbindung gebracht.7
All dies deutet darauf hin, dass Alternativen zu Antibiotika dringend benötigt werden, und zwar bevorzugt solche, die ein gezieltes Abtöten pathogener Bakterien bei gleichzeitigem Schutz der gutartigen Teile des Mikrobioms erlauben.
Vielversprechende Alternativen
Bakteriophagen sind die häufigste biologische Entität auf der Erde. Es wird vermutet, dass Bakterien seit ihrer Entstehung vor Milliarden von Jahren von spezialisierten Viren befallen werden.8 Natürlich vorkommende Phagen lysieren in der Regel nur einzelne Stämme innerhalb einer Bakterienspezies. Zudem sind sie äußerst effizient gegen bakterielle Biofilme, da sie spezielle Enzyme bilden, die die Schleimschicht des Biofilms abbauen und so den Zugang zu den dort lebenden Bakterien ermöglichen. Mit Hilfe gezielter Züchtungsverfahren können bestimmte Eigenschaften der Bakteriophagen, wie beispielsweise das Wirtsspektrum oder die Halbwertszeit im Blut, verbessert werden.9 Ein aufwendiger, aber für pharmazeutische Phagen notwendiger Schritt, weil die Wildtypen als Arzneimittel-Wirkstoffe sonst kaum geeignet sind.
Neben replizierenden Phagen stellen auch einzelne Phagenenzyme interessante Wirkstoffkandidaten dar. Die sogenannten Endolysine werden am Ende des viralen Replikationszyklus gebildet, um die Wirtszelle zu lysieren. Sie haben in isolierter Form vielversprechende pharmakologische Eigenschaften und werden von einigen Firmen bereits zu Arzneimitteln entwickelt.10 Das österreichische Biotech-Unternehmen PhagoMed Biopharma GmbH ist ein Pionier bei der Entwicklung von phagenbasierten Arzneimitteln, inklusive replizierender Phagen und Endolysine, zur Behandlung von implantatassoziierten Infektionen, bakterieller Vaginose und Harnwegsinfektionen.
Sicher, aber auch effektiv?
Bereits seit ihrer Entdeckung im Jahr 1917 werden Phagen medizinisch eingesetzt. Vor allem in osteuropäischen Ländern sind sie seit Jahrzehnten als Arzneimittel verfügbar und können regulär in Apotheken erworben werden. Während Phagen nach entsprechender Aufreinigung selbst bei intravenöser Anwendung als sehr sicher gelten, haben bisher aber nur wenige klinische Studien nach heute akzeptierten Standards deren Effektivität für spezifische Indikationen geprüft. Auch wichtige Aspekte wie Pharmakokinetik oder Stabilität sind nur wenig erforscht.
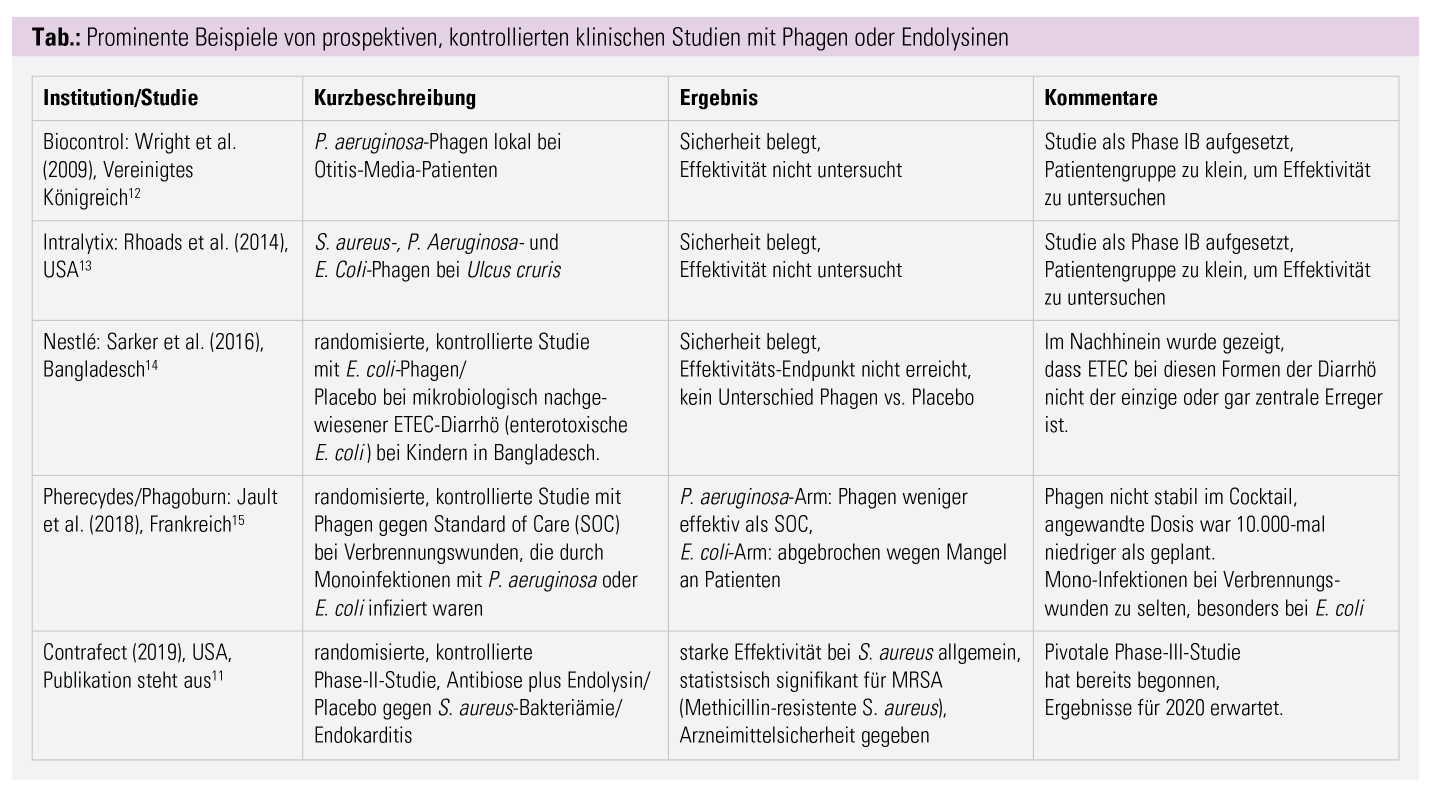
Zwar wurden in den letzten Jahren einige prospektive, randomisierte, kontrollierte Studien abgeschlossen, allerdings konnte keine dieser Studien die Wirkung der Phagen belegen. Ein Teil der Studien war ohnehin als reine Sicherheitsstudie (Phase I) konzipiert, andere wurden mit Prämissen geplant, die sich ex post als falsch erwiesen (Tab.).
Auch Endolysine stehen als neuartige antimikrobielle Arzneimittelklasse erst am Anfang der Entwicklung. Erfreulicherweise konnte 2019 jedoch eine erste klinische Studie einen signifikanten Vorteil eines Endolysins bei der Behandlung der Bakteriämie und Endokarditis durch Methicillin-resistente S. aureus (MRSA) zeigen. Die Publikation der Ergebnisse in einem Fachjournal steht allerdings noch aus.11
Erfolgreiche Einzelfälle
Für spezielle Anwendungsgebiete, wie muskuloskeletale und implantatassoziierte Infektionen, erweisen sich Phagen jedoch schon heute als vielversprechende Therapieoption. In einer Serie von Heilversuchen an Patienten mit diabetischem Fußsyndrom zeigten Phagen eine vielversprechende Effektivität.16 In einem anderen Fall konnte eine rekurrierende S.-aureus-Infektion an einem Kunstherzen erfolgreich mit einem Phagenpräparat behandelt werden, nachdem eine Antibiotikabehandlung fehlgeschlagen war.17 Weitere erfolgreiche Behandlungen bei Osteomyelitis18 bestärken den Eindruck, dass Phagen bei spezifischen Anwendungen durchaus effektiv wirken und sogar in Synergie mit einer Antibiotikatherapie eingesetzt werden können. Einige aufsehenerregende Einzelfälle zeigen auch das Potenzial von Bakteriophagen bei multiresistenten Keimen. Der Fall Patterson fand dabei 2015 besonderes Medienecho. Tom Patterson hatte sich während einer Ägyptenreise mit einem multiresistenten Acinetobacter baumanii infiziert. Sein Zustand verschlechterte sich rapide, und sein Leben konnte letztlich nur durch die intravenöse Anwendung eines Phagenpräparates gerettet werden.19 Der erste therapeutische Einsatz eines gentechnisch veränderten Phagen erfolgte 2018 bei einer 15-jährigen Mukoviszidose-Patientin, die an einer ausgestreuten Infektion mit multiresistentem Mycobacterium abscessum litt. Die Infektion verhinderte zunächst eine dringend notwendige Lungentransplantation, konnte aber bereits kurz nach Beginn der Phagentherapie eingedämmt werden.20
2020 – das Jahr der Phagen?
Bereits jetzt kristallisieren sich zwei mögliche Varianten der Phagentherapie heraus: fixe Cocktails mehrerer Phagen für eine bestimmte Indikation und ein personalisierter Ansatz, bei dem für jeden Patienten spezifische Phagen aus einer Phagenbank ausgewählt werden. Fixe Cocktails werden derzeit von Unternehmen wie PhagoMed (Österreich), BiomX (Israel; Akne und entzündliche Darmerkrankungen) und Armata Pharmaceuticals (USA; P.-aeruginosa-Phagen für Mukoviszidose, S.-aureus-Phagen für Bakteriämien) entwickelt. Der personalisierte Ansatz wird zum Beispiel durch das US-Unternehmen Adaptive Phage Therapeutics verfolgt.
Für das Jahr 2020 werden mehrere klinische Studien erwartet. BiomX hat die Rekrutierung für eine Studie zur Behandlung von Akne mit einem Phagencocktail abgeschlossen. Armatas Studie zur Effektivität von P.-aeruginosa-Phagen bei Mukoviszidose soll ebenfalls heuer starten. Im Bereich der Endolysine ist man bereits etwas weiter. So plant das Pharmaunternehmen Contrafect für 2020 eine Phase-III-Studie zur Behandlung von MRSA-Bakteriämien und Endokarditis. Dabei handelt es sich schon um eine pivotale Studie, die zur Marktzulassung des ersten Endolysinpräparats führen könnte.
Fazit
Bakteriophagen und Endolysine sind vielversprechende Alternativen zu Antibiotika und in vielen Fällen mit ihnen synergistisch. Gerade bei persistierenden und biofilmassoziierten Infektionen – also Indikationen, die auch unabhängig von Resistenzen mit Antibiotika nur schwer zu behandeln sind – könnten sie den Therapiestandard deutlich verbessern. Die nächsten Herausforderungen liegen darin, kritische pharmakologische Eigenschaften zu verstehen und die Effektivität mit klinischen Studien zu belegen. Dann könnten phagenbasierte Arzneimittel schon bald Realität werden und dazu beitragen, das postantibiotische Zeitalter abzuwenden.