Was empfiehlt die Literatur bei aggressiver Polyarthritis?
Geschwollene Gelenke können eine diagnostische Herausforderung darstellen. Bei Vorliegen einer chronisch-entzündlichen Gelenkserkrankung sollte die Therapie aber rasch etabliert werden.
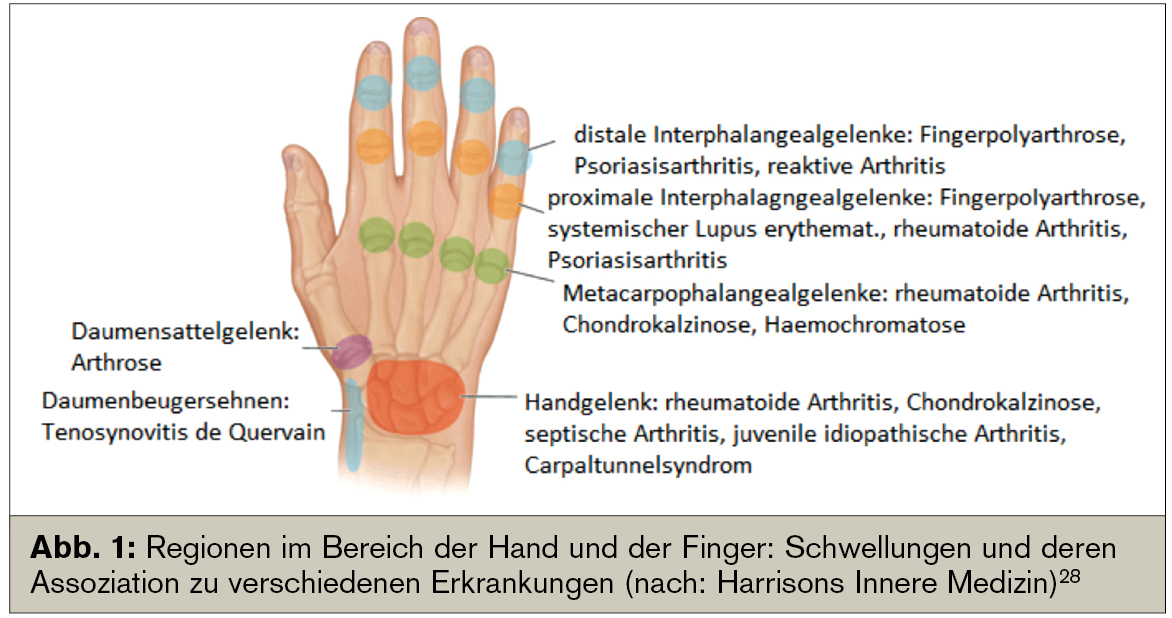
Bei der Begutachtung eines Patienten mit dem klinischen Befund „Polyarthritis“ kommen differenzialdiagnostisch eine Reihe von Ursachen in Frage: Neben der – unter den entzündlichen rheumatologischen Erkrankungen am häufigsten gesehenen – rheumatoiden Arthritis (RA) können mehrere geschwollene Gelenke auch ein Hinweis auf seronegative Spondyloarthropathien wie Psoriasisarthritis sein, oder im Rahmen einer Kollagenose oder Polymyalgia rheumatica auftreten. Auch an eine septische Arthritis oder Kristallarthropathie ist zu denken, und letztlich auch an degenerative Gelenkserkrankungen (Abb. 1).
Zur Diagnosefindung werden das Verteilungsmuster des peripheren Gelenkbefalls, zusätzlicher axialer Befall, extraartikuläre Manifestationen sowie die Anamnese und Laborbefunde miteinbezogen. Symmetrische synovitische Schwellungen an den proximalen Interphalangeal- und Metakarpophalangealgelenken sprechen dabei für die Diagnose RA1, und auch die Anzahl der befallenen Gelenke hat große Aussagekraft, wobei 4–10 oder sogar mehr als 10 synovitisch geschwollene Gelenke eine RA bereits sehr wahrscheinlich machen.2
Wichtig ist aber, dass eventuelle diagnostische Unsicherheiten in der Frühphase nicht zur Verzögerung einer entzündungshemmenden Therapie führen sollten. Die Abgrenzung chronisch-entzündlicher gegenüber anderen Arthropathien muss daher rasch getroffen werden, und die Zeit bis zur Vorstellung beim Facharzt für Rheumatologie gilt als wichtiger Indikator für die Qualitätssicherung des Patientenmanagements bei Polyarthritis:3, 4 Diese sollte nach einer Vorgabe der European League Against Rheumatism (EULAR) maximal 6 Wochen betragen.5
Das „Window of opportunity“
Die Rationale hinter dieser Empfehlung ist, dass gerade am Beginn von chronisch-entzündlichen Gelenkserkrankungen in kurzer Zeit beträchtlicher Schaden an den Gelenken entstehen kann. Bei Patienten mit frisch diagnostizierter RA konnten in bis zu 72 % der Fälle Erosionen im Röntgen bereits innerhalb weniger Monate nach Symptombeginn dokumentiert werden.6 Andererseits ist gut belegt, dass die effektive Unterdrückung der Krankheitsaktivität in der Frühphase die radiologische Progression im weiteren Verlauf deutlich verzögert und die körperliche Funktionalität erhält.7 Neben der Gelenksdestruktion durch die lokale Entzündung rücken immer mehr die Auswirkungen von chronisch-entzündlichen Systemerkrankungen auf die Gesamtmortalität und hier besonders auf das kardiovaskuläre Risiko ins Bewusstsein. Die RA gilt als eigenständiger kardiovaskulärer Risikofaktor8, und gerade auch für die Auswirkungen der Erkrankung auf die Mortalität konnte erst kürzlich anhand von Registerdaten die Wichtigkeit eines optimalen therapeutischen Managements am Beginn der Erkrankung gezeigt werden: Wer früh und anhaltend in Remission gebracht werden kann, hat eine höhere Lebenserwartung als Patienten, die erst später in Remission kommen.9
Aggressive Verlaufsformen
Ineffektiv unterdrückte Synovitis führt zur progressiven Gelenkszerstörung, und diese radiologischen Schäden sind maßgeblich am Verlust von Funktion beteiligt.10 Die Aggressivität des Krankheitsverlaufs kann allerdings äußerst variabel sein, und im Einzelfall vorherzusagen, ob es bei einem konkreten Patienten rasch zur Entwicklung von Erosionen kommt, ist schwierig. Man weiß aber, dass einige Faktoren als Prädiktoren für das frühe Auftreten von Erosionen gewertet werden können: Es sind dies neben einer hohen Entzündungsaktivität das Bestehen von bereits abgelaufenen radiologischen Schäden sowie Seropositivität.11–13
„Positiv“ – Antikörper von Gewicht
Von einer seropositiviten Arthritis spricht man im Fall der Nachweisbarkeit von Rheumafaktor (RF) und/oder Antikörpern gegen zitrullinierte Peptide und Proteine (ACPA) im Serum. Beide Antikörper sind diagnostisch von Bedeutung, um eine Arthritis bereits früh als RA zu identifizieren2, allerdings gibt es auch seronegative RA-Varianten. Prognostisch deuten RF und ACPA – vor allem in sehr hohen Titern – auf ein erhöhtes Risiko zu früher radiologischer Progression hin.14–19 Für den Rheumafaktor wurde dies erst rezent auch unabhängig von der Krankheitsaktivität gezeigt.20
Guidelines und therapeutischer Algorithmus
Aus dem oben Gesagten ergibt sich ein gewisses Risikoprofil für Patienten, an einer aggressiven, also früh erosiven Verlaufsform einer RA zu leiden. Wichtig ist aber zu betonen, dass der therapeutische Approach zunächst für alle Patienten derselbe ist: Gemäß den EULAR-Empfehlungen soll so rasch wie möglich eine Basistherapie mit „disease-modifying antirheumatic drugs“ (DMARD) begonnen werden, sowohl bei diagnostisch gesicherter RA12 als auch bei undifferenzierter Früharthritis, wenn die etablierten Klassifikationskriterien (noch) nicht erfüllt sind5, da auch hier ein günstiger Effekt von frühem DMARD-Einsatz auf das radiologische Outcome nachgewiesen ist.21 Als Goldstandard gilt dabei nach wie vor Methotrexat (MTX)5, 12, bei Kontraindikation können alternativ Leflunomid oder Sulfasalazin zum Einsatz kommen.12
Weiters spielen besonders in der Frühphase der Therapie auch Kortikosteroide eine Rolle. Diese sollen aber bevorzugt kurzzeitig systemisch oder lokal als intraartikuläre Injektion erwogen werden.5, 12, 22
Das Ziel ist eine vollständige Unterdrückung der Entzündungsaktivität, also Remission, zumindest sollte aber rasch eine niedrige Krankheitsaktivität5, 12, 13, 23 erreicht werden, um die kumulative Entzündungsaktivität zu minimieren.4 Visiten zur Verlaufskontrolle sollten im Abstand von 1 bis 3 Monaten durchgeführt werden5, 12, 23, und der therapeutische Erfolg sollte mithilfe validierter Aktivitätsscores24–26 objektiviert und dokumentiert werden.23 Bei suboptimalem Therapieansprechen unter MTX kommen als nächster Schritt Biologika zum Einsatz12, wobei hier Tumornekrosefaktor-Inhibitoren, Interleukin-6(IL-6)-Blocker, B-Zell-Depletoren und T-Zell-Co-Stimulationsblocker zur Verfügung stehen. (Diese Therapien werden meist mit MTX kombiniert. Wenn aber – zum Beispiel bei MTX-Unverträglichkeit – eine Biologika-Monotherapie indiziert ist, scheint nach neuesten Daten auch die Monotherapie mit dem IL-6-Inhibitor Tocilizumab ein gangbarer Weg.27)
Die Empfehlungen der Fachgesellschaften sehen den Übertritt in diese „Phase II“ der Therapie, also den Beginn mit Biologika nach MTX-Versagen, dann vor, wenn innerhalb von 3 bis spätestens 6 Monaten das therapeutische Ziel Remission (oder zumindest niedrige Krankheitsaktivität) nicht erreicht wird. Die Entscheidung zur therapeutischen Eskalation sollte bei Vorhandensein von prognostisch ungünstigen Faktoren wie hochtitrigen RF/ACPA, sehr hoher Krankheitsaktivität oder bereits abgelaufenen Erosionen umso rascher getroffen werden.12, 13 Gleichlautend zur Evaluation der MTX-Therapie wird für Biologika gefordert, nach spätestens 3–6 Monaten bei Nichterreichen des Therapieziels weitere Anpassungen, also den Wechsel auf ein anderes Biologikum vorzunehmen12, 13 (Abb. 2). Neben der Therapie der Grunderkrankung sollte im Hinblick auf die oben erwähnte kardiovaskuläre Morbidität ein konsequentes Management zusätzlicher Risikofaktoren wie Nikotinabusus, arterielle Hypertonie, Hyperlipidämie etc. Teil des Behandlungsplans sein.8
Zusammenfassend ist vor allem die Bedeutung des frühen Therapiestarts – auch bei noch nicht gesicherter Diagnose – hervorzuheben, weil dadurch irreversible radiologische Schäden am effektivsten aufgehalten werden können. Die spezielle Herausforderung von aggressiv verlaufenden Arthritiden, gekennzeichnet durch Seropositivität, hohe Entzündungsaktivität und früh auftretende Erosionen, liegt im besonders engmaschigen Monitoring und im Fall von suboptimalem Ansprechen in der raschen Adaptierung der Therapie, um Funktion, Lebensqualität und Arbeitsfähigkeit der Patienten zu erhalten.